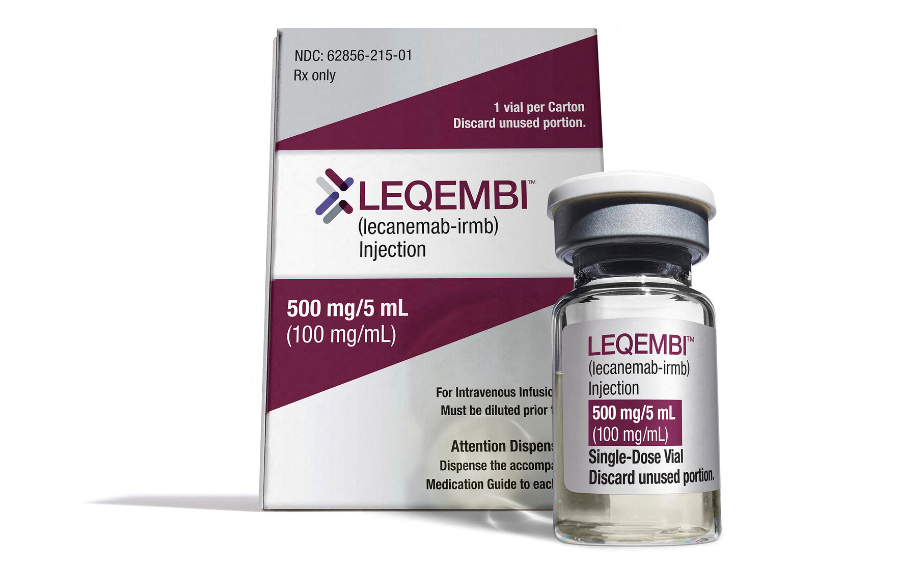
Det første anti-amyloid lægemiddel mod Alzheimers demens er nu godkendt af EMA, og kan derfor måske snart anvendes i Danmark.
Der er en ny klasse af demenslægemidler på vej på markedet – de såkaldte anti-amyloide lægemidler. Indtil videre har de dog ikke vist imponerende resultater, hvorfor lægemidlerne ikke har kunnet opnå godkendelse. Nu er det første anti-amyloide lægemiddel godkendt af EMA, det europæiske lægemiddelagentur. Det er Lecanemab der er blevet godkendt af EMA.
Lecanemab blev ellers i første omgang afvist af EMA. Begrundelsen for dette var at der kun var dokumenteret en beskeden effekt, men samtidig var der bekymring for alvorlige bivirkninger. Disse bivirkninger var ARIA, hvor man så forandringer på en MR scanning af hjernen med mikroblødninger og ødemer.
Man har ved EMA godkendelsen vurderet at patienter med APOE-e4 alleller, en særlig genvariant af Alzheimers sygdom, ikke må få Lecanemab. Dette skyldes at man så hyppigere ARIA ved denne gruppe af patienter. Derfor vil kun patienter uden APOE-e4 eller én kopi kunne behandles, mens dem med to kopier ikke vil kunne behandles.
Nu hvor Lecanemab er godkendt af EMA skal det vurderes af Medicinrådet om det kan tilbydes til alle eller en gruppe patienter med Alzheimers demens. Medicinrådets vurdering forventes offentliggjort september 2025. Indførelsen af Lecanemab kan potentielt ændre meget på demensudredningen i Danmark, da Lecanemab kræver opstart af behandlingen i et meget tidligt stadie, og så kræver det jævnlige besøg på sygehuset for at få behandlingen.