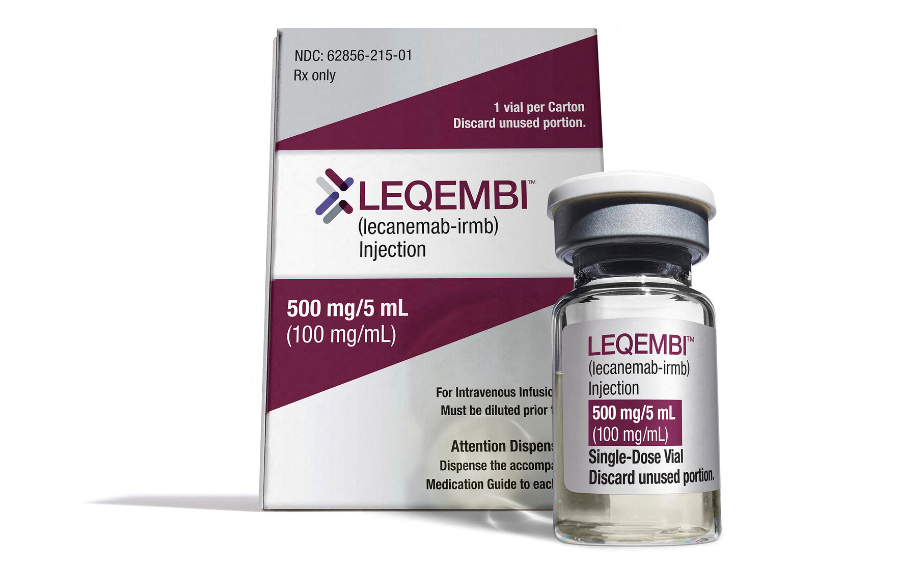
EMA har afvist ansøgningen om markedsføringstilladelse til demenslægemidlet Lecanemab, fordi effekten er for lille ift. bivirkningerne.
I disse år er der udviklet flere anti-amyloide lægemidler til behandling af Alzheimers demens. De virker ved at reducere Amyloid-beta i hjernen, som menes at være en vigtig forudsætning for udviklingen af Alzheimers demens. Ved at fjerne dette i et tidligt stadie håber man på at kunne bremse udviklingen af demenssygdommen. Der er kommet tre lægemidler på markedet: aducanumab, lecanemab og donanemab. Tidligere afviste EMA godkendelsen af Aducanumab, og i dag afviste de også lægemidlet Lecanemab.
Selvom den nye generation af demenslægemidler af nogle beskrives som en revolution er effekten af lægemidlerne beskedne. Alle lægemidler er gode til at reducere Amyloid-beta i hjernen, men man har ikke kunnet se nogen markant effekt i udviklingen af de kognitive symptomer hos de demente. Også effekten af Lecanemab er beskeden, og derfor har EMA vurderet at effekten ikke står mål med de bivirkninger der er ved lægemidlet.
Den mest bekymrende bivirkning ved disse lægemidler er det såkaldte ARIA, der står for “Amyloid-Related Imaging Abnormalities”. Det er en bivirkning der kom frem i forbindelse med studiet af anti-amyloide lægemidler, hvor man så nogle patienter blive indlagt med abnorme MRC scanninger. På scanningen fandt man forandringer der kaldes for ARIA, der repræsenterer ødemer og i nogle tilfælde også mikroblødninger i hjernen. De fleste tilfælde var milde og forbigående, men det er en bekymrende alvorlig bivirkning ved disse lægemidler, som vi endnu ikke forstår tilstrækkeligt.
EMA har på baggrund af den beskedne effekt og de alvorlige bivirkninger altså vurderet at effekten ikke står mål med bivirkningerne ved lægemidlet, og derfor er Aducanumab og Lecanemab ikke godkendt. I USA ser de anderledes på det, her har de godkendt alle tre lægemidler. Dog blev Aducanumab senere trukket tilbage fra markedet igen med samme vurdering, effekten står ikke mål med bivirkningerne.
Det betyder at amerikanerne vil have mulighed for at behandle Alzheimers Demens med to lægemidler vi ikke har adgang til i EU. Det er ikke nødvendigvis dårlig, dels da effekten som nævnt er lille og dels fordi der så kommer real world data fra USA der vil belyse effekten af lægemidlerne mere de kommende år. EMA har endnu ikke taget stilling til det tredje lægemiddel Donanemab, om det kan blive godkendt i EU.