I USA er der blevet godkendt endnu et monoklonalt antistof mod Alzheimers demens. Jeg kigger nærmere på fase 3 studiet her.
For nogle måneder siden kom fase 3 studiet for Lecanemab – et af de nye monoklonale antistoffer rettet mod Amyloid-beta i sygdommen Alzheimers Demens. Amyloid-beta menes at spille en rolle i denne sygdom og håbet er at man kan bremse sygdommen ved at fjerne amyloid-beta i hjernen. Det er her Lecanemab virker, og i januar 2023 fik blev de godkendt af FDA i USA under en Accelerated Approval Pathway. Det er en godkendelse hvor den endelige godkendelse er betinget af at producenten yderligere dokumenterer effekten af lægemidlet i et studie efter godkendelsen.
Det er ikke det første monoklonale antistof mod Amyloid-beta. I juni 2021 godkendte FDA også Aducanumab til behandling af Alzheimers demens, også under en Accelerated Approval Pathway. Det er også et monoklonalt antistof rettet mod Amyloid-beta, men hvor Lecanemab især er rettet mod protofibrillerne, så er Aducanumab rettet mod plaques. Producenten søgte også EMA om markedsføringstilladelse, men denne blev trukket tilbage, da EMA alligevel havde tænkt sig at afvise den. Baggrunden for dette var, at selvom producenten havde vist dokumentation for at Aducanumab reducerede Amyloid-beta i hjernen, så var den kliniske betydning af dette ikke vist. Det ene fase 3 studie EMERGE viste også der var en effekt, mens det andet fase 3 studie ENGANGE ikke kunne demonstrere en effekt. Samtidig havde studierne vist forekomst af en alvorlig bivirkning, hvor man havde set forekomst af ARIA på scanninger af hjernen.
Nu er det andet monoklonale antistof så kommet, og de har også sendt en ansøgning ind til EMA. Vi ved endnu ikke hvad resultatet af denne ansøgning bliver.
Selve studiet
Fase 3 studiet for Lecanemab er et dobbelt-blinded RCT, hvor man inkluderede 1.795 patienter i alderen 50-90 år, som havde fået påvist MCI eller mild Alzheimers demens og påvist amyloid-beta enten på en PET/CT eller lumbalpunktur. Halvdelen af deltagerne fik hver anden uge 10 mg/kg Lecanemab, mens den anden halvdel fik placebo. De fulgte deltagerne i 18 måneder, og sammenlignede så ændringen i CDR-SB score mellem interventions- og kontrolgruppen. Sekundært kiggede man på ændringen i amyloid-byrden på PET/CT, ændring i ADAS-cog14 score, ændring i ADCOMS-score og ændring i ADCS-MCI-ADL-score.
Baseline for CDR-SB-score var gennemsnitlig 3,2 i begge grupper og dette faldt over 18 måneder 1,21 i interventionsgruppen og 1,66 i kontrolgruppen. Man så altså en forskel på 0,45 point, hvilket svarer til en relativ effekt på 27% eller en absolut effekt på 2,5%. Tidligere studier har kigget på hvor stor ændringen i CDR-SB score skal være for at det er klinisk meningsfuld, og her vurderes det at effekten skal være mindst 1-2 point.
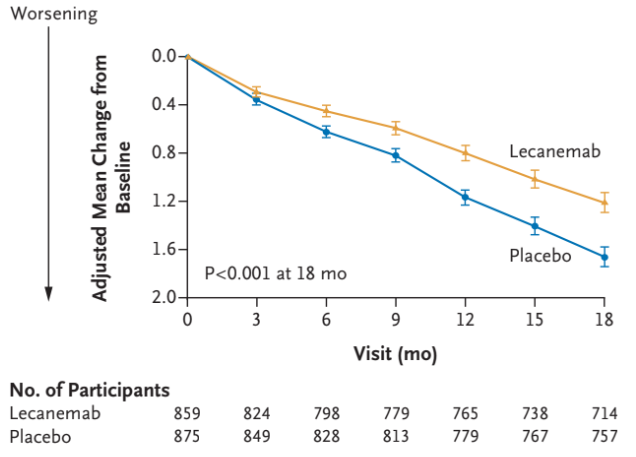
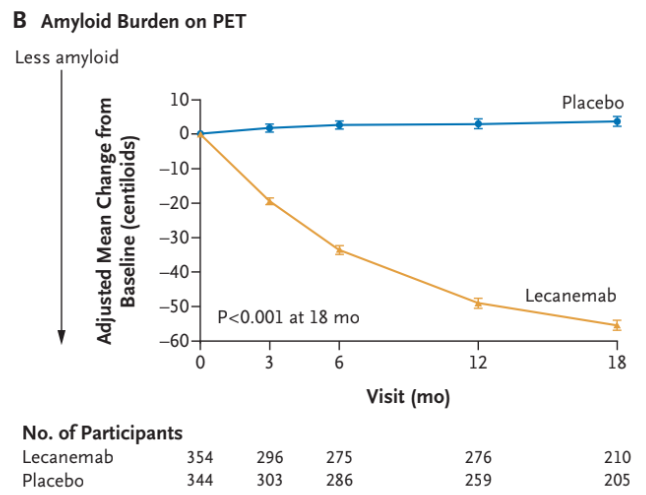
Man så også et større fald for dem der fik Lecanemab i Amyloid-byrden, ADAS-cog14-score, ADCOMS-score og en stigning i MCL-ADL-score forenelig med en effekt på kognitiv svækkelse. Med andre ord har man i studiet både kigget på billeddiagnostiske tegn til reduktion i amyloid-beta og en klinisk effekt på kognitiv svækkelse udfra kognitive tests.
Der blev selvfølgelig også set bivirkninger ved behandlingen med Lecanemab. Cirka 1 ud af 4 fik infusionsrelaterede bivirkninger, mens 12,6% fik ARIA-E og 17,3% fik ARIA-H. ARIA kom som regel inden for de første 3 måneder efter opstart af behandlingen og gik væk igen inden for 4 måneder. Incidensen var højest for de ApoE ε4 homozygote patienter – gener der er associeret med højere risiko for Alzheimers demens generelt.
Fase 3 studiet er selvfølgelig finansieret af de to producenter Eisai og Biogen, hvilket man selvfølgelig skal tage højde for. Man kan ikke undgå påvirkning fra producenterne i den slags studier, og der fremgår da også at forfatterne fik “professional medical writing assistance” sponsoreret af producenterne.
Udfordringer ved lægemidlet
Hvis man skal kigge på lægemidlets udfordringer er der flere at få øje på. En af dem er at det er rettet mod patienter med MCI og let alzheimers demens. Det rummer to udfordringer. For det første behandles MCI ikke i dag, og en del af dem med MCI vil ikke udvikle demens. For det andet kan det være vanskeligt at diagnosticere Alzheimers demens så tidligt, og det vil uden tvivl stille store krav til sundhedsvæsnet at kunne dette.
Noget andet er det rent praktiske som kræves for at kunne blive behandlet med lægemidlet. Det skal gives som en infusion hver 2. uge, så det kræver at disse ældre kognitivt svækkede patienter skal ind på sygehuset mange gange i løbet af et år.
Endelig er der også bivirkningerne. Ligesom de andre monoklonale antistoffer var ARIA en alvorlig bivirkning, og i fase 3 studiet blev det faktisk set ved mere end 1 ud af 10 deltagere. En så hyppig og alvorlig bivirkning kræver en god klinisk effekt for at stå mål med dette. Når det er sagt, så var det dog kun 3,5% symptomatiske ARIA tilfælde.
Bedre end Aducanumab, men godt nok?
Både Aducanumab og Lecanemab har i de kliniske studier vist en klar effekt ift. at reducere mængden af amyloid-beta i hjernen. Når det kommer til effekten har Aducanumab i det ene fase 3 studie vist en effekt, mens det andet ikke viste en effekt på reduktion i kognitiv svækkelse. Her har Lecanemab kunnet demonstrere en effekt. Om den er klinisk relevant nok er svært at vurdere. Til gengæld er det bekymrende med de alvorlige ARIA bivirkninger, og det synes også uhensigtsmæssig at patienterne så hyppigt skal ind på hospitalet for at få sin behandling. Endelig kunne det også være godt at se nogle flere studier der målte på nogle mere hårde parametre som for eksempel mortialitet, morbiditet og funktionsniveau.
Referencer
- Christopher H. van Dyck, M.D., Chad J. Swanson, Ph.D., Paul Aisen, M.D., Randall J. Bateman, M.D., Christopher Chen, B.M., B.Ch., Michelle Gee, Ph.D., Michio Kanekiyo, M.S., David Li, Ph.D., Larisa Reyderman, Ph.D., Sharon Cohen, M.D., Lutz Froelich, M.D., Ph.D., Sadao Katayama, M.D., et al. Lecanemab in Early Alzheimer’s Disease. January 5, 2023. N Engl J Med 2023; 388:9-21. DOI: 10.1056/NEJMoa2212948.
- FDA Grants Accelerated Approval for Alzheimer’s Disease Treatment (FDA 6/1-2023).
- FDA Grants Accelerated Approval for Alzheimer’s Drug (FDA 7/6-2021).
- Aduhelm: Withdrawal of the marketing authorisation application (EMA 22/4-2022).
- Medicines for human use under evaluation (EMA 26/1-2023).
- Alzheimer’s Disease Genetics Fact Sheet (NIH)
- Budd Haeberlein S, Aisen PS, Barkhof F, Chalkias S, Chen T, Cohen S, Dent G, Hansson O, Harrison K, von Hehn C, Iwatsubo T, Mallinckrodt C, Mummery CJ, Muralidharan KK, Nestorov I, Nisenbaum L, Rajagovindan R, Skordos L, Tian Y, van Dyck CH, Vellas B, Wu S, Zhu Y, Sandrock A. Two Randomized Phase 3 Studies of Aducanumab in Early Alzheimer’s Disease. J Prev Alzheimers Dis. 2022;9(2):197-210. doi: 10.14283/jpad.2022.30. PMID: 35542991.
- Andrews JS, Desai U, Kirson NY, Zichlin ML, Ball DE, Matthews BR. Disease severity and minimal clinically important differences in clinical outcome assessments for Alzheimer’s disease clinical trials. Alzheimers Dement (N Y). 2019 Aug 2;5:354-363. doi: 10.1016/j.trci.2019.06.005. PMID: 31417957; PMCID: PMC6690415.
- Lansdall CJ, McDougall F, Butler LM, Delmar P, Pross N, Qin S, McLeod L, Zhou X, Kerchner GA, Doody RS. Establishing Clinically Meaningful Change on Outcome Assessments Frequently Used in Trials of Mild Cognitive Impairment Due to Alzheimer’s Disease. J Prev Alzheimers Dis. 2023;10(1):9-18. doi: 10.14283/jpad.2022.102. PMID: 36641605.
- The Lancet. Lecanemab for Alzheimer’s disease: tempering hype and hope. Lancet. 2022 Dec 3;400(10367):1899. doi: 10.1016/S0140-6736(22)02480-1. PMID: 36463893.